Arana-Peña S, Carballares D, Morellon-Sterling R, Rocha-Martin J, Fernandez-Lafuente R.
The combination of covalent and ionic exchange immobilizations enables the coimmobilization on vinyl sulfone activated supports and the reuse of the most stable immobilized enzyme.
Int J Biol Macromol. 2021 Dec 30;199:51-60.
DOI: 10.1016/j.ijbiomac.2021.12.148
RESUMEN
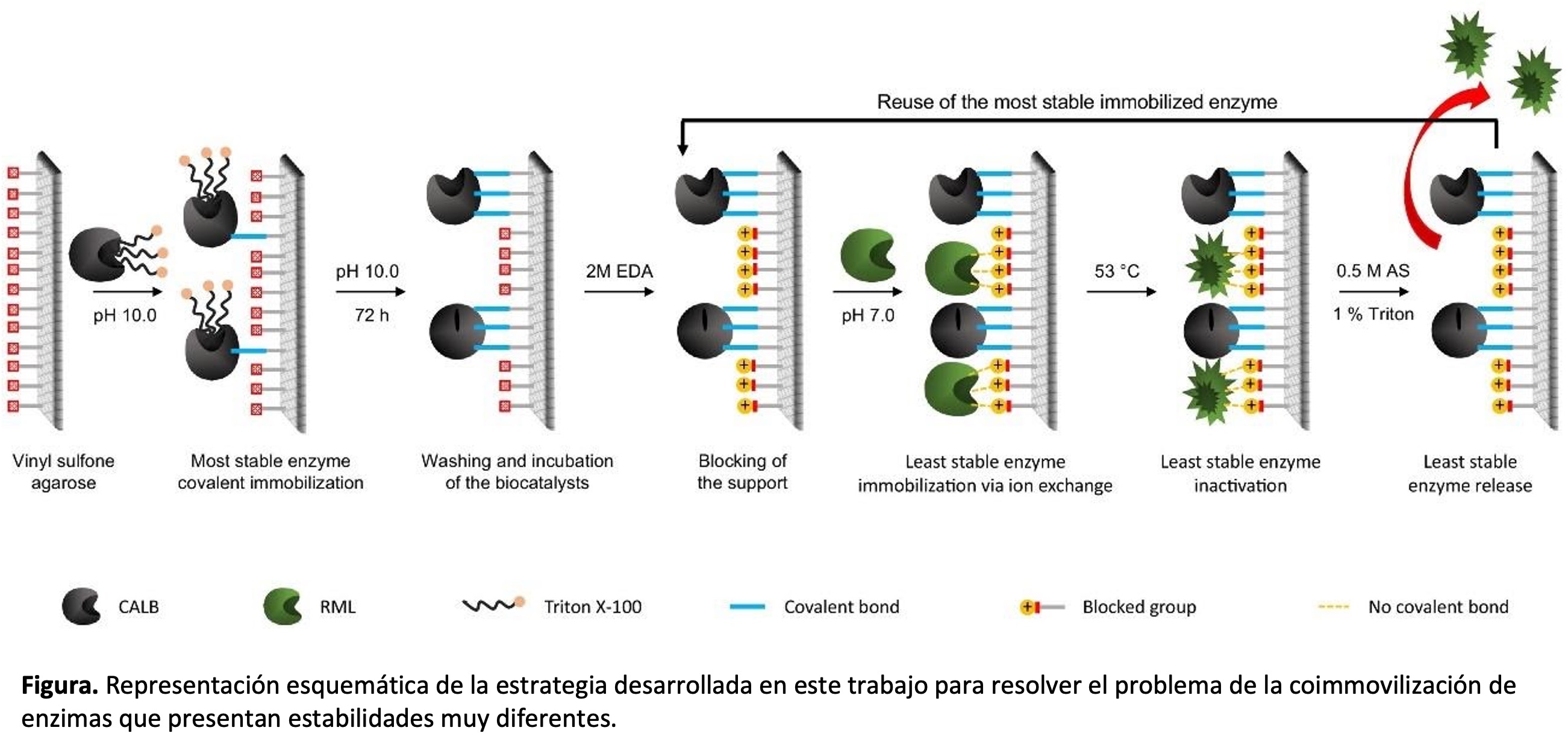
Este trabajo muestra un ejemplo de coimmovilización de dos enzimas en perlas de agarosa activadas con sulfona de vinilo, cuando una de las enzimas no puede ser inmovilizada en este soporte. Para alcanzar este objetivo, se inmovilizó covalentemente una de las enzimas, y tras bloquear el soporte con etilendiamina, y convertir el soporte en un intercambiador aniónico, se inmovilizó la otra enzima sobre el soporte. La lipasa de Candida antarctica (CALB) inmovilizada covalentemente fue mucho más estable que la lipasa de Rhizomucor miehei (RML) inmovilizada por intercambio iónico, de modo que el biocatalizador combi-lipasa debía desecharse cuando se mantuviera el 90% de la actividad de la CALB. La liberación de la RML inactivada con sulfato de amonio y detergente permitió recuperar el biocatalizador de CALB inmovilizado casi idéntico a los primeros biocatalizadores de CALB, y la coinmovilización de un lote fresco de enzima RML permitió recuperar un combi-biocatalizador con las mismas propiedades que el inicial. Este es un ejemplo modélico del potencial de este soporte para ser utilizado como solución al problema de la coimmovilización de enzimas con diferente estabilidad. Este biocatalizador puede tener aplicación en la producción de ácidos grasos libres a partir de la hidrólisis de aceites, o de biodiésel, biolubricantes o biosurfactantes a partir de aceites de ácidos grasos libres, ya que todos estos procesos implican sustratos heterogéneos compuestos por muchos componentes diferentes, y la especificidad enzimática puede ser un problema para su plena conversión.